- Photon-Counting-Detektoren – Die Zukunft der kardiovaskulären CT-Bildgebung
Seit seiner Markteinführung im Jahr 2021 haben zahlreiche Studien die Überlegenheit der Photon-Counting-Detektor-Computertomographie in der kardialen Bildgebung im Vergleich zur konventionellen CT gezeigt. Die Kombination aus ultrahoher Auflösung, spektraler Bildinformation und der höchstmöglichen zeitlichen Auflösung verbessert die Bildqualität und reduziert Artefakte, insbesondere bei der Koronar-CT und der Stent-Bildgebung.
Since its market introduction in 2021, numerous studies have shown the superiority of photon-counting detector computed tomography in cardiac imaging in comparison to conventional CT. The combination of ultra-high-resolution, spectral imaging capabilities and the highest available temporal improved image quality and reduced artifacts, especially in coronary CT and stent imaging.
Key Words: Cardiovascular computer tomography; Dual source geometry; photon‐counting detector CT; Spectral imaging.
Einleitung
Die photonenzählende Detektor-Computertomographie (PCD-CT), die seit 2021 klinisch verfügbar ist, markiert eine bedeutende Weiterentwicklung in der CT-Bildgebung. Im Vergleich zu konventionellen CT-Systemen, die Energie-integrierende Detektoren (EID-CT) verwenden, bietet die PCD-CT eine verbesserte räumliche Auflösung, eine Reduktion von Bildartefakten und eine spektrale Bildgebung. Alle diese Eigenschaften ermöglichen eine Verbesserung der kardiovaskulären und insbesondere der Koronar-CT-Bildgebung.
Technologische Grundlagen
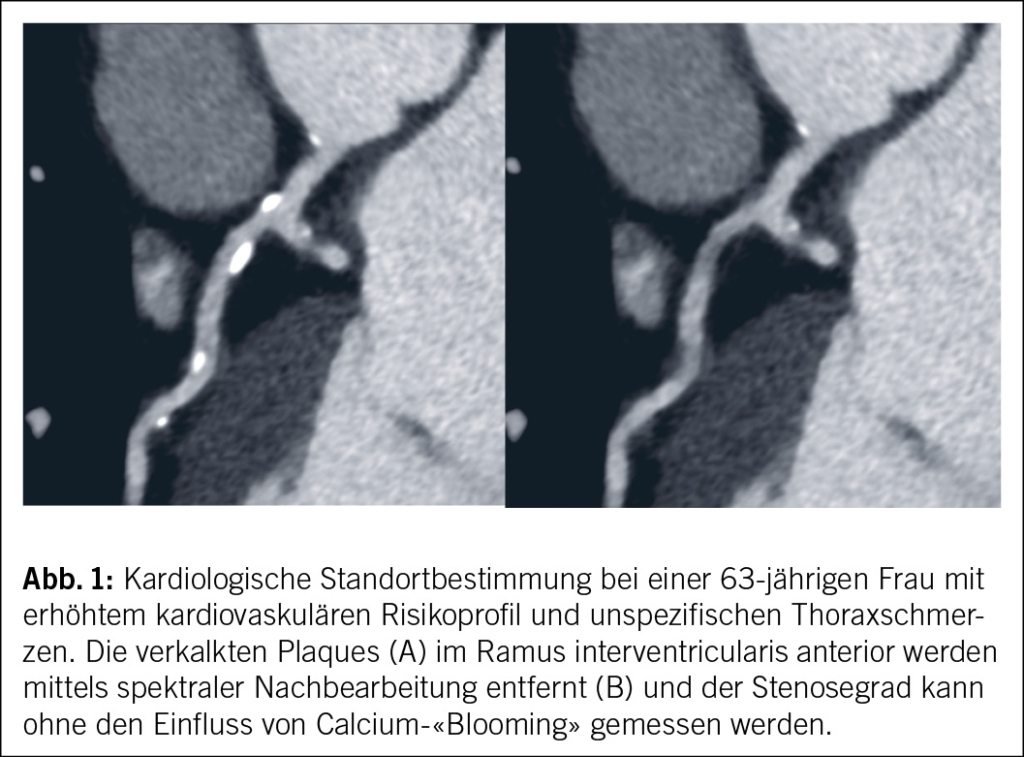
Bei konventionellen EID-CT-Systemen wird die Erzeugung eines elektrischen Signals durch detektierte Röntgenphotonen mittels eines Zwischenschritts, der Umwandlung der Photonen in sichtbares Licht, ermöglicht. Die direkte Photonenzählung mittels PCD-CT kommt ohne diesen Zwischenschritt aus, in dem Halbleiterdetektoren, z. B. aus Cadmiumtellurid oder Cadmiumzinktellurid die direkte Umwandlung der einfallenden Röntgenphotonen in elektrische Signale ermöglichen. Durch die direkte Umwandlung der Photonen am Detektor kann sowohl das Auftreffen des Photons selbst als auch dessen Energielevel erfasst werden, es liegt daher bei jedem Scan die multi-energetische (oder spektrale) Information vor. Die spektrale Datenauswertung kann zum Beispiel durch die Eliminierung des elektronischen Rauschens zur Reduktion des Bildrauschens benutzt werden, durch Rekonstruktion von virtuell monoenergetischen Bildern zur Erhöhung des Kontrastmittelsignals (tiefere keV-Level) oder zur Reduktion von Aufhärtungs- und Metallartefakten (höhere keV-Level) eingesetzt werden. Zusätzlich kann virtuell Kalk (Abb. 1) oder Jod auf spektraler Basis getrennt werden und entsprechend nur die Kalk- bzw. Jodinformation dargestellt werden.
Ein zusätzlicher Vorteil der PCD-CT ist die fehlende Notwendigkeit von Septen zwischen den Detektorelementen, was die Dosiseffizienz verbessert und eine deutlich höhere räumliche Auflösung mit Schichtdicken von unter 0.2 mm ermöglicht (sog. ultra-high-resolution, UHR-Modus). Die ist vor allem zur Reduktion von Aufhärtungsartefakten durch Kalk oder Stentmaterial (sogenannter «blooming»-Artefakt) vorteilhaft. Aktuell sind PCD-CT-Scanner nur von einer Firma kommerziell verfügbar und klinisch zugelassen, während weitere Hersteller PCD-CT-Systeme bisher nur als Forschungs-Prototypen betreiben. Für eine eingehende Übersicht über die Technik der PCD-CT-Systeme verweisen wir auf andere Reviews (1, 2).
Vorteile der PCD-CT in der klinischen Anwendung
Calcium-Scoring
Das Calcium-Scoring (CAC-Scoring) mittels Agatston-Score wurde Anfang der 1990er Jahre entwickelt und dient als quantitatives Mass für die Verkalkungen der Koronararterien und damit als Surrogatparameter für das Ausmass der Atherosklerose der Koronararterien (3). Es kann als Prädiktor für die Wahrscheinlichkeit des Auftretens von schweren kardiovaskulären Ereignissen (MACE) dienen und ist ein besserer Prädiktor als konventionelle klinische Faktoren (4, 5).
Wolf et al. konnten in einer Phantomstudie zeigen, dass die PCD-CT-Technologie eine genauere Bestimmung des Kalkvolumens im Vergleich zur EID-CT-Technologie ermöglicht (7). Die Quantifizierung des Agatston-Scores auf virtuell monoenergetischen Bildrekonstruktionen ermöglicht zudem die Akquisition des CAC-Scans auch mit niedrigen Röhrenspannungen und somit die Möglichkeit der Dosisreduktion für native CT-Scans. Hierdurch sind in Phantomstudien Dosiseinsparungen von bis zu 48 % möglich (8). Die Möglichkeit der virtuell nativen Bildrekonstruktionen bei Datenakquisition mit unterschiedlichen Röhrenspannungen ermöglichen hier eine Vergleichbarkeit des Agatston-Scores ohne die Notwendigkeit eines Konversionsfaktors wie sie zum Beispiel bei herkömmlichen EID-CT Scans mit reduzierter Röhrenspannung notwendig wären.
Die virtuell native Bildrekonstruktion nach spektraler Eliminierung der Jod-Information ermöglicht die Quantifizierung von Koronarkalk oder Kalk der Aortenklappe ohne dedizierte Akquisition eines nativen CT-Scans, was einen kompletten Verzicht auf diesen zusätzlichen CT-Scan erlaubt. Mergen et al. konnten zeigen, dass virtuell native Rekonstruktionen die Quantifizierung von Kalk mit einer hohen Vergleichbarkeit mit herkömmlichen nativen CAC-Scans ermöglichen (Kappa-Wert 0.97 für die Übereinstimmung von Risikokategorien) (9).
Koronar-CT-Angiographie
Die überwältigende wissenschaftliche Evidenz in den letzten zwei Jahrzehnten führte zu einem hohen Stellenwert der Koronar-CT-Angiographie mit Klasse Ia Indikation für die primäre Diagnostik des chronischen Koronarsyndroms bei Patienten mit tiefer bis mittlerer Vortestwahrscheinlichkeit für eine obstruktive Koronare Herzkrankheit. Die Konfiguration des derzeit verfügbaren PCD-CT-Scanners mit zwei Röhren spielt hier eine wichtige Rolle für die Datenqualität im UHR-Modus. In einer Studie von Mergen et al. wurden Daten mit einer mittleren Herzfrequenz von 72 +/– 10/min und einer Herzfrequenzvariabilität von 5 +/– 6 /min mit der Information von nur einer Röhre (zeitliche Auflösung von 125 ms, dies entspricht einer typischen zeitlichen Auflösung von Systemen mit einer Röhre) oder mit der Information beider Röhren (schnellste verfügbare zeitliche Auflösung eines CT von 66 ms) rekonstruiert. Diese Studie zeigte, dass die Bildqualität bei höherer zeitlicher Auflösung signifikant besser war – mit weniger Bewegungsartefakten, höherer Bildschärfe, einer verbesserten Abgrenzbarkeit der Gefässwände und reduzierten sogenannten «Blooming»-Artefakten (10).
Die spektrale Rekonstruktion von monoenergetischen Bilder nmit tiefen keV-Stufen kann durch ein Erhöhen des Jodsignals in den Bildern und dadurch einem erhöhten Signal-zu-Rauschen (SNR) bzw. Kontrast-zu-Rauschen (CNR) Verhältnis dazu eingesetzt werden die Kontrastmitteldosis und/oder die Strahlendosis zu reduzieren. Im Gegensatz zu EID-CTs, bei denen ein erhöhtes SNR oder CNR durch einen Scan mit tieferer Röhrenspannung vor allem bei schlanken Patienten möglich ist, profitieren am PCD-CT insbesondere Patienten mit erhöhtem Body-Mass-Index von einem höheren Signal in den Bildern (11).
Graduierung von Koronarstenosen
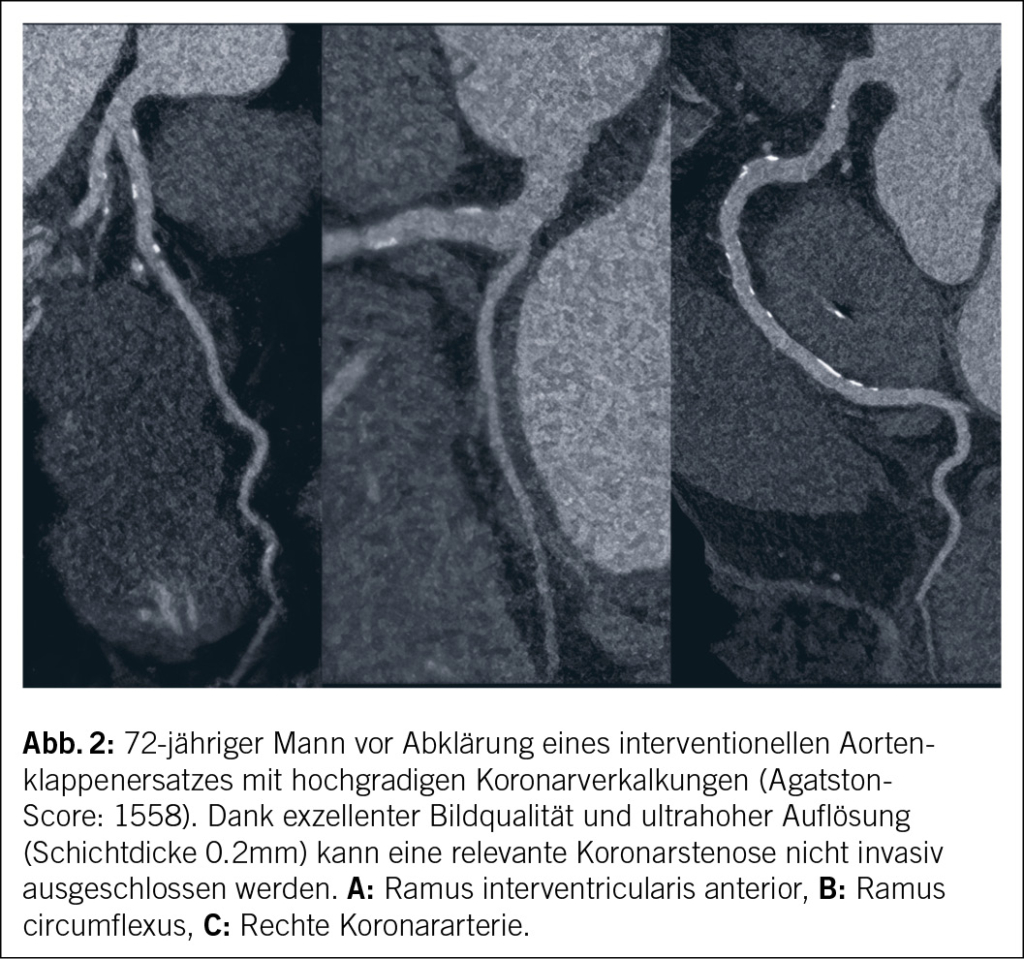
Die PCD-CT ermöglicht durch die verbesserte räumliche Auflösung (im UHR-Modus bis 0.11 mm) eine Reduktion des «Bloomings» von kalkhaltigen Plaques (Abb. 2) bzw. von Aufhärtungsartefakten von Stents (12). Als Folge fanden mehrere Studien somit eine verbesserte Bestimmung des Stenosegrads, insbesondere angrenzend an kalkhaltige Koronarplaques (13). Halfmann et al. zeigten zum Beispiel eine Abhängigkeit des koronaren Stenosegrades von der rekonstruierten Schichtdicke mit geringeren Stenosegraden durch verkalkte Plaques bei höherer Auflösung und sonst identischen Protokollparametern (14). In dieser Studie sank der mediane Stenosegrad von 42 % (Standardrekonstruktion) auf 27 % (UHR). Bei knapp über 50 % der Patienten führte dies zu einer tieferen Einstufung des Stenosegrades nach dem Klassifikationssystem nach CAD-RADS (Coronary Artery Disease – Reporting and Data System). Vecsey-Nagy et al. konnten zeigen, dass im Vergleich zum EID-CT, die Stenose durch verkalkte und partiell verkalkte Plaques mittels PCD-CT signifikant kleiner gemessen wird (Mittelwert von 45 % im Vergleich zu 55 %) (12). Eberhard et al. zeigten, dass die UHR-Rekonstruktion mit 0.2mm Schichtdicke (im Vergleich zur Standardrekonstruktion mit 0.6mm) zu einer signifikant besseren Übereinstimmung des Stenosegrads im Vergleich zur invasiven Koronarangiographie (Stenosegraduierung mittels 3D-QCA [quantitative coronary angiography]) führt (13). In einer kürzlich erschienenen Studie bestätigten Kotronias et al. diese Ergebnisse an einem grösseren Kollektiv, bei dem ein akutes Koronarsyndrom mittels PCD-CT abgeklärt wurde. Auch hier zeigt sich eine sehr hohe Übereinstimmung des Stenosegrads zwischen UHR-PCD-CT und 3D-QCA mit Überlegenheit gegenüber der Standardschichtdicke (0.6 mm) vor allem bei stark verkalkten Plaques (κ = 0.90 im Vergleich zu κ = 0.67) (15).
Plaquecharakterisierung
Neben der Beurteilung des Stenosegrads ermöglicht die Koronar-CT auch die Darstellung und quantitative Charakterisierung atherosklerotischer Plaques (16). Die Koronar-CT dient somit als nicht-invasive Alternative zu invasiven Verfahren wie IVUS (intravaskulärer Ultraschall) oder OCT (optische Kohärenztomographie). Plaques mit niedriger Dichte («low attenuation plaques») gelten als stärkster Prädiktor für unerwünschte Koronarereignisse bei Patienten mit akuten und chronischen Koronarsyndromen (17). Insbesondere unter Berücksichtigung der Wirksamkeit neuartiger Antiatherosklerotika gewinnt dieses Thema zunehmend an Bedeutung. Die UHR-PCD-CT verbessert hier durch die höhere Auflösung die Beurteilbarkeit von Plaques (18). Im Vergleich zu einer Standardrekonstruktion mit 0.6 mm ermöglicht die UHR-Rekonstruktion mit 0.2 mm eine detailreichere Beurteilbarkeit der Plaques auf mehreren Schichten. Mergen et al. konnten zeigen, dass mit zunehmender Stärke des Rekonstruktionskerns sowie abnehmender Schichtdicke bei partiell verkalkten Plaques der «blooming»-Artefakt von Kalk und somit die Überschätzung des verkalkten Plaqueanteils reduziert und die Darstellung der fibrotischen und fettreichen Anteile verbessert werden kann (16). Vecsey-Nagy und Kollegen kamen kürzlich zur Schlussfolgerung, dass das totale Plaquevolumen mit der UHR-PCD-CT im Vergleich zur EID-CT signifikant kleiner ist, wobei insbesondere die Reproduzierbarkeit von Plaques mit niedriger Dichte verbessert wird (19).
Beurteilung von Koronarstents
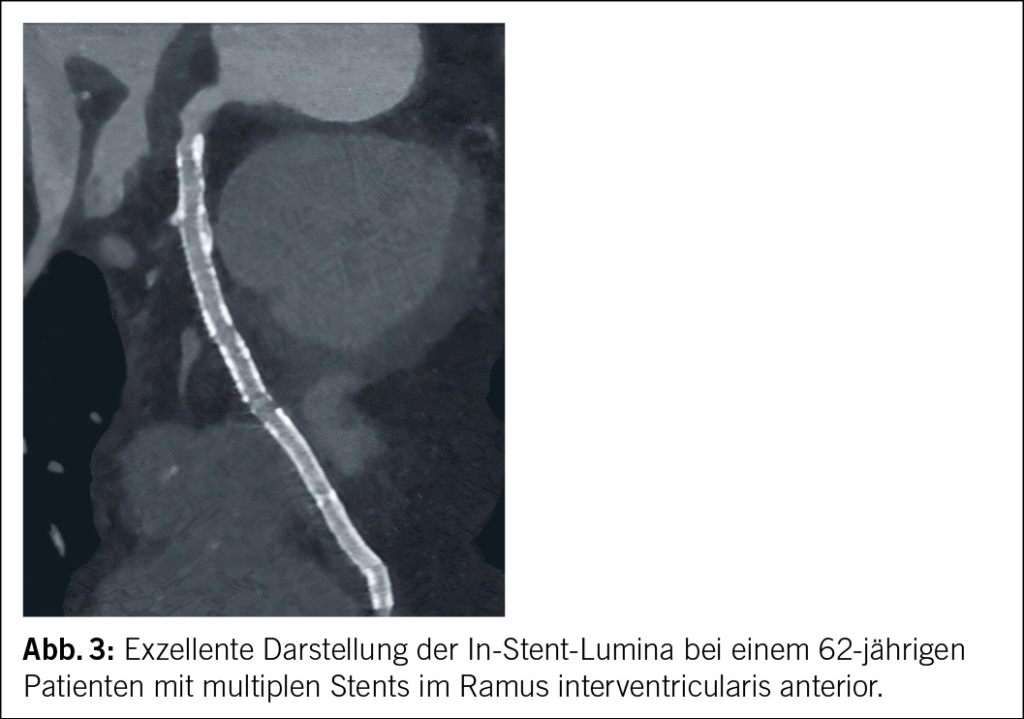
Eine Analyse von Eckert et al. zeigte, dass die Abklärung einer In-Stent-Restenose bei symptomatischen Patienten durch ein EID-CT der neuesten Generation bei einem Viertel der Patienten entweder einen unklaren oder einen falsch positiven Befund ergibt (20). Erste Phantomversuche zeigten die Überlegenheit der PCD-CT gegenüber der EID-CT bei der Abgrenzung des Stentlumens (21, 22). Geering et al. konnten diese Ergebnisse in einer in-vivo Studie mit 34 Stents von 19 Patienten mittels subjektiver und objektiver Parameter bestätigen (23). Qin et al. zeigten an 69 Patienten, dass die Visualisierung des In-Stent-Lumens durch UHR-PCD-CT-Rekonstruktionen mit 0.2 mm Schichtdicke signifikant verbessert wurde, im Vergleich zu Standardrekonstruktionen mit 0.6 mm Schichtdicke (24). Hagar et al. schliesslich konnten bei 44 Stents von 18 Patienten zeigen, dass im Vergleich zur Beurteilung mittels invasivem Katheter, die Beurteilung mit UHR PCD-CT eine sehr hohe Sensitivität (100 %), Spezifität (87–92 %) und Genauigkeit (89–93 %) zeigten (25). Abb. 3 zeigt ein Fallbeispiel einer Stentbeurteilung anhand PCD-CT.
Fat attenuation Index
Eine erhöhte Dichte des perikoronaren Fettgewebes in der CT ist ein indirekter Marker für eine perikoronare Entzündung, die mit einer erhöhten kardiovaskulären Morbidität und Mortalität einhergeht (26). Der «fat attenuation index» (FAI) ermöglicht, die Dichte des perikoronaren Fettgewebes standardisiert zu messen. Der Index wird jedoch durch Scanparameter wie zum Beispiel dem Energielevel der virtuell monoenergetischen Rekonstruktionen, der Stärke der iterativen Rekonstruktion, der Dichte des Koronarlumens sowie dem Rekonstruktionskernel beeinflusst (27, 28). Die PCD-CT bietet hier die Möglichkeit durch virtuell monoenergetische Rekonstruktionen und FAI-Messungen weiter zu standardisieren.
Gewebecharakterisierung des Myokards
In der klinischen Routine ist die Beurteilung des Myokards eine Domäne der kardialen Magnetresonanztomographie (MRT oder MRI) oder bei spezifischen Fragestellungen der nuklearmedizinischen Bildgebung. Die CT kann jedoch ebenfalls alternativ zur Myokardcharakterisierung eingesetzt werden. 5–10 Minuten nach Kontrastmittelgabe wird hierzu ein sogenannter «late iodine enhancement»-Scan durchgeführt (29). Durch die Quantifizierung des Iodsignals kann, ähnlich zum MRI, das extrazelluläre Volumen des Myokards berechnet werden. Ein typisches Beispiel ist hier die Detektion einer kardialen Amyloidose. Im Gegensatz zur EID-CT sind bei der PCD-CT keine zwei Scans zur Berechnung des extrazellulären Volumens notwendig, was einerseits den Untersuchungsablauf und die Berechnung vereinfacht, und andererseits hilft, Fehler bei der Registrierung von nativem und «late iodine enhancement»-Scan zu vermeiden (30). Die Werte für das extrazelluläre Volumen, die mittels PCD-CT gemessen werden, sind dabei sehr gut mit den Werten, die mittels MRI bestimmt werden, vergleichbar (r = 0.91) (31). Falls kein Hämatokrit-Wert zur Berechnung des extrazellulären Volumens vorliegt, kann im Übrigen der Hämatokrit anhand der Bilddaten «synthetisch» berechnet werden (32).
Zukünftige Entwicklungen
Trotz der vielversprechenden Ergebnisse bringt die Integration der PCD-CT in die klinische Praxis auch einige Herausforderungen. Durch die dünneren Schichtdicken ergeben sich deutlich mehr Bilder pro Rekonstruktion, die befunden werden müssen. Auch die spektralen Möglichkeiten ergeben pro Fall mehrere zusätzliche Rekonstruktionen, deren potentiell nützliche Informationen gesichtet und beurteilt werden sollten. Insgesamt steigt so neben den verfügbaren Informationen auch der Arbeitsaufwand. Die zukünftige Kombination von spektraler Bildgebung und künstlicher Intelligenz könnte die diagnostischen Möglichkeiten der PCD-CT optimieren, insbesondere bei der automatisierten Analyse von Pathologien.
Fazit
Die PCD-CT stellt die Zukunft der kardiovaskulären Bildgebung dar. Ihre Vorteile hinsichtlich räumlicher Auflösung, Bildqualität, Strahlendosis und spektraler Bildgebung eröffnen neue diagnostische Möglichkeiten (Tab. 1). Insbesondere in der Koronardiagnostik und der Stent-Bildgebung zeigt diese Technologie ihr enormes Potenzial. Zukünftige Forschungsarbeiten werden den vollen klinischen Nutzen dieser Technologie validieren und helfen, ihre Anwendung zu optimieren.
Copyright
Aerzteverlag medinfo AG
Institut für Diagnostische und Interventionelle Radiologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Institut für Diagnostische und Interventionelle Radiologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
M.E und H.A.: Referentenhonorare und Reisekostenunterstützung von Siemens Healthineers
- Die photonenzählende Detektor-Computertomographie (PCD-CT) erhöht durch die höhere Ortsauflösung die Sicherheit in der Koronar-CT-Bildgebung.
- Der Vorteil der PCD-CT zeigt sich insbesondere in der Stenosequantifizierung angrenzend an verkalkte Plaques und in der verbesserten Beurteilbarkeit von In-Stent-Restenosen.
- Die PCD-CT ermöglicht jederzeit die spektrale Nachbearbeitung der Bilddaten, zum Beispiel zur virtuellen Eliminierung von Kalk oder Jod.
1. Greffier J, Viry A, Robert A, et al. Photon-counting CT systems: A technical review of current clinical possibilities. Diagn Interv Imaging. 2025;106(2):53-9.
2. McCollough CH, Rajendran K, Leng S, et al. The technical development of photon-counting detector CT. Eur Radiol. 2023;33(8):5321-30.
3. Agatston AS, Janowitz WR, Hildner FJ, et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990;15(4):827-32.
4. Yakupoglu HY, Grani C. Role of imaging in primary prevention: calcium score is a robust and cost-efficient risk modifier. Swiss Med Wkly. 2019;149:w20183.
5. Eberhard M, Hinzpeter R, Schonenberger ALN, et al. Incremental Prognostic Value of Coronary Artery Calcium Score for Predicting All-Cause Mortality after Transcatheter Aortic Valve Replacement. Radiology. 2021;301(1):105-12.
6. McCollough CH, Ulzheimer S, Halliburton SS, et al. Coronary artery calcium: a multi-institutional, multimanufacturer international standard for quantification at cardiac CT. Radiology. 2007;243(2):527-38.
7. Wolf EV, Halfmann MC, Schoepf UJ, et al. Intra-individual comparison of coronary calcium scoring between photon counting detector- and energy integrating detector-CT: Effects on risk reclassification. Front Cardiovasc Med. 2022;9:1053398.
8. Mergen V, Higashigaito K, Allmendinger T, et al. Tube voltage-independent coronary calcium scoring on a first-generation dual-source photon-counting CT-a proof-of-principle phantom study. Int J Cardiovasc Imaging. 2022;38(4):905-12.
9. Mergen V, Ghouse S, Sartoretti T, et al. Cardiac Virtual Noncontrast Images for Calcium Quantification with Photon-counting Detector CT. Radiol Cardiothorac Imaging. 2023;5(3):e220307.
10. Mergen V, Sartoretti T, Cundari G, et al. The Importance of Temporal Resolution for Ultra-High-Resolution Coronary Angiography: Evidence From Photon-Counting Detector CT. Invest Radiol. 2023;58(11):767-74.
11. Euler A, Higashigaito K, Mergen V, et al. High-Pitch Photon-Counting Detector Computed Tomography Angiography of the Aorta: Intraindividual Comparison to Energy-Integrating Detector Computed Tomography at Equal Radiation Dose. Invest Radiol. 2022;57(2):115-21.
12. Vecsey-Nagy M, Tremamunno G, Schoepf UJ, et al. Intraindividual Comparison of Ultrahigh-Spatial-Resolution Photon-Counting Detector CT and Energy-Integrating Detector CT for Coronary Stenosis Measurement. Circ Cardiovasc Imaging. 2024;17(10):e017112.
13. Eberhard M, Candreva A, Rajagopal R, et al. Coronary Stenosis Quantification With Ultra-High-Resolution Photon-Counting Detector CT Angiography: Comparison With 3D Quantitative Coronary Angiography. JACC Cardiovasc Imaging. 2024;17(3):342-4.
14. Halfmann MC, Bockius S, Emrich T, et al. Ultrahigh-Spatial-Resolution Photon-counting Detector CT Angiography of Coronary Artery Disease for Stenosis Assessment. Radiology. 2024;310(2):e231956.
15. Kotronias RA, de Maria GL, Xie C, et al. Benchmarking Photon-Counting Computed Tomography Angiography Against Invasive Assessment of Coronary Stenosis: Implications for Severely Calcified Coronaries. JACC Cardiovasc Imaging. 2025.
16. Mergen V, Eberhard M, Manka R, et al. First in-human quantitative plaque characterization with ultra-high resolution coronary photon-counting CT angiography. Front Cardiovasc Med. 2022;9:981012.
17. Williams MC, Kwiecinski J, Doris M, et al. Low-Attenuation Noncalcified Plaque on Coronary Computed Tomography Angiography Predicts Myocardial Infarction: Results From the Multicenter SCOT-HEART Trial (Scottish Computed Tomography of the HEART). Circulation. 2020;141(18):1452-62.
18. Mergen V, Sartoretti T, Baer-Beck M, et al. Ultra-High-Resolution Coronary CT Angiography With Photon-Counting Detector CT: Feasibility and Image Characterization. Invest Radiol. 2022;57(12):780-8.
19. Vecsey-Nagy M, Tremamunno G, Schoepf UJ, et al. Coronary Plaque Quantification with Ultrahigh-Spatial-Resolution Photon-counting Detector CT: Intraindividual Comparison with Energy-integrating Detector CT. Radiology. 2025;314(3):e241479.
20. Eckert J, Renczes-Janetzko P, Schmidt M, et al. Coronary CT angiography (CCTA) using third-generation dual-source CT for ruling out in-stent restenosis. Clin Res Cardiol. 2019;108(4):402-10.
21. Mannil M, Hickethier T, von Spiczak J, et al. Photon-Counting CT: High-Resolution Imaging of Coronary Stents. Invest Radiol. 2018;53(3):143-9.
22. Petritsch B, Petri N, Weng AM, et al. Photon-Counting Computed Tomography for Coronary Stent Imaging: In Vitro Evaluation of 28 Coronary Stents. Invest Radiol. 2021;56(10):653-60.
23. Geering L, Sartoretti T, Mergen V, et al. First in-vivo coronary stent imaging with clinical ultra high resolution photon-counting CT. J Cardiovasc Comput Tomogr. 2023;17(3):233-5.
24. Qin L, Zhou S, Dong H, et al. Improvement of coronary stent visualization using ultra-high-resolution photon-counting detector CT. Eur Radiol. 2024;34(10):6568-77.
25. Hagar MT, Soschynski M, Saffar R, et al. Ultra-high-resolution photon-counting detector CT in evaluating coronary stent patency: a comparison to invasive coronary angiography. Eur Radiol. 2024;34(7):4273-83.
26. Chan K, Wahome E, Tsiachristas A, et al. Inflammatory risk and cardiovascular events in patients without obstructive coronary artery disease: the ORFAN multicentre, longitudinal cohort study. Lancet. 2024;403(10444):2606-18.
27. Pitteloud J, Moser LJ, Klambauer K, et al. Effect of Vessel Attenuation, VMI Level, and Reconstruction Kernel on Pericoronary Adipose Tissue Attenuation for EID CT and PCD CT: An Ex Vivo Porcine Heart Study. AJR Am J Roentgenol. 2024.
28. Mergen V, Ried E, Allmendinger T, et al. Epicardial Adipose Tissue Attenuation and Fat Attenuation Index: Phantom Study and In Vivo Measurements With Photon-Counting Detector CT. AJR Am J Roentgenol. 2022;218(5):822-9.
29. Cundari G, Galea N, Mergen V, et al. Myocardial extracellular volume quantification with computed tomography-current status and future outlook. Insights Imaging. 2023;14(1):156.
30. Mergen V, Sartoretti T, Klotz E, et al. Extracellular Volume Quantification With Cardiac Late Enhancement Scanning Using Dual-Source Photon-Counting Detector CT. Invest Radiol. 2022;57(6):406-11.
31. Cundari G, Deilmann P, Mergen V, et al. Saving Contrast Media in Coronary CT Angiography with Photon-Counting Detector CT. Acad Radiol. 2024;31(1):212-20.
32. Mergen V, Ehrbar N, Moser LJ, et al. Synthetic hematocrit from virtual non-contrast images for myocardial extracellular volume evaluation with photon-counting detector CT. Eur Radiol. 2024.
info@herz+gefäss
- Vol. 15
- Ausgabe 2
- Mai 2025