- Semaglutid bei T2DM und CKD: FLOW-Studie und zwei Subanalysen
Diabetes mellitus Typ 2 (T2DM) und die chronische Nierenerkrankung (CKD) nehmen weltweit stark zu. Diabetes und Hypertonie sind die Hauptursachen einer CKD. Das Mortalitätsrisiko ist bei Patienten mit einem T2DM und CKD über 10 Jahre 4 × höher als ohne diese beiden Erkrankungen; Die Lebenserwartung ist vor allem wegen den kardiovaskulären (cv) Folgeerkrankungen deutlich vermindert. Das Risiko für eine rasche Progression der CKD ist erhöht. Durch eine Adipositas können diese und die cv Folgeerkrankungen (Hypertonie, HI, KHK, VHFli) deutlich verschlimmert werden. Diese Krankheiten beeinflussen sich gegenseitig. Ab einer Urin-Albumin-Kreatinin Ratio (UACR) von 5mg/g steigt das Risiko bez. cv Mortalität kontinuierlich an und je schlechter die eGFR, desto höher sind die cv Komplikationen.
GLP-1 Rezeptor-Agonisten (GLP-1 RA) reduzieren das Gewicht, verbessern den Blutzucker, verringern cv Ereignisse bei T2DM und haben wie die SGLT2-H. kardio- und nephroprotektive Wirkungen. An der Niere wirken sie antientzündlich und antioxidativ, verstärken die Natriurese und hemmen die Fibrose. Auch haben sie eine pluripotente Wirkung auf verschiedene Organe.
In der 2024 publizierten RCT-Studie FLOW (1) reduzierte Semaglutid das Risiko für klinisch bedeutsame renale Endpunkte sowie den kardiovaskulären Tod und die Gesamtmortalität in der Hochrisikopopulation von 3533 Patientinnen und Patienten mit T2DM und CKD mit einer eGFR von ≥50 – ≤75ml/min/1,73m2 und einer UACR >300 – <5000mg/g oder einer eGFR von ≥25 – <50ml und einer UACR >100 – <5000mg/g; HbA1c ≤10%., in der Vorgeschichte 22,9% MI oder Apoplexie, 19,2% HI.
Diese Studie ist insofern relevant, da 79,6% eine eGFR von weniger als 60ml/min/1,73 m² und 11,3% eine eGFR von weniger als 30ml/min/1,73 m² aufwiesen (96,9% StadiumA2 oder höher, davon 68,5% Stadium A3). Im Durchschnitt (D) waren die Patienten 66,6 Jahre, die D-eGFR betrug 47, die D-UACR 567,6mg/g Kreatinin, 15,6% hatten einen SGLT2-H. Die Studie wurde infolge positiven Resultaten vorzeitig abgebrochen.
Mit einer s. c. Semaglutid-Dosis von 1mg/Woche (Diabetes-Dosis) über durchschnittlich 3,4 Jahre vs. Placebo u. einer Standardtherapie (RAS-H., potentes Statin, Diuretika, Insulin) im Verh. 1:1 konnte der primär kombinierte Endpunkt: Nieren-Outcome, bestehend aus ≥50% Abfall der geschätzten eGFR, eGFR <15 ml/min/1,73 m², Beginn einer Nierenersatztherapie, renaler und kardiovaskulärer Tod, um 24% (HR 0.76; p=0.0003) gesenkt werden. Dies entspricht in 3 Jahren einer sehr guten NNT von 20, zur Verhinderung von einem primären Ereignis. Die sekundären Endpunkte cv-Tod, MACE (cv-Tod, MI, Apo) und Gesamtmortalität wurden auch reduziert, die jährliche eGFR-Abnahme (Slope) war unter Semaglutid weniger stark als unter Placebo. Vorteile gab es auch in Bezug auf Albuminurie, Gewichtsreduktion (-4kg), verbesserten Stoffwechsel und die BD-Kontrolle.
In einer vordefinierten Analyse der Flow-Studie konnte gezeigt werden, dass das Risiko eines kombinierten Ergebnisses von HI-Ereignissen oder kardiovaskulärem Tod und HI-Ereignissen allein signifikant um 27 % reduziert wurde. Das Risiko, allein am Herz-Kreislauf-Tod zu versterben, wurde um 29 % gesenkt. Die positiven Wirkungen von Semaglutid waren bei Teilnehmern mit und ohne HI zu Studienbeginn und in einer Reihe klinisch relevanter Untergruppen ähnlich (2).
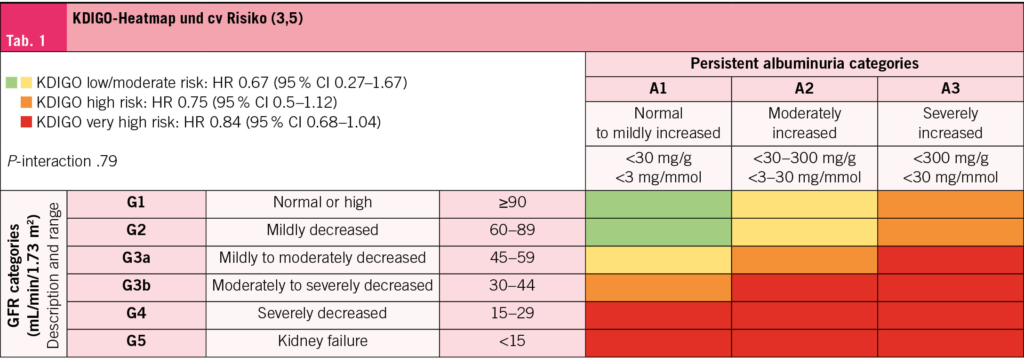
In einer weiteren vorab spezifizierten Analyse der FLOW-Studie wurden die Auswirkungen dieses GLP-1‑RA auf die cv‑Ereignisse und die Sterblichkeit durch den Schweregrad der CKD untersucht (3). Die Ergebnisse zeigen, dass Semaglutid das Risiko für den cv-Tod, nicht-tödlichen Herzinfarkt und nicht-tödlichen Schlaganfall um 18% sowie die Sterblichkeit jeglicher Ursache um 20% reduziert. Diese positiven Effekte waren unabhängig von der Schwere der CKD, gemessen durch die geschätzte glomeruläre Filtrationsrate (eGFR: <60 oder ≥60 ml/min/1.73 m²), das Albumin-Kreatinin-Verhältnis im Urin (UACR-Werten von <300 oder ≥300 mg/g) und die KDIGO-Risikoklassifikation «heat map»: Albuminurie und eGFR, die in niedriges/moderates bei 6,8% der Patienten (HR: 0,67), hohes bei 24,9% (HR: 0,75) und sehr hohes Risiko bei 68,3% der Patienten (HR: 0,84) eingeteilt wurde. Dieses Risiko bezieht sich auf den cv-Tod, den nicht fatalen MI und den nicht fatalen Stroke (Tab. 1).
Fazit
Semaglutid reduziert deutlich das Risiko klinisch wichtiger Nierenergebnisse und des Todes durch kardiovaskuläre Ursachen bei Hochrisiko-Patienten mit Typ-2-Diabetes und chronischer Nierenerkrankung.
• Das Risiko eines kombinierten Ergebnisses von HI-Ereignissen oder kardiovaskulärem Tod und HI-Ereignissen allein wurde signifikant reduziert.
• Auch reduziert dieser GLP-1 RA das Risiko für kardiovaskulären Tod/MI/Schlaganfall unabhängig vom Schweregrad der CKD zu Studienbeginn.
Semaglutid sollte als Teil der therapeutischen Strategie zur Verringerung des kardiovaskulären Risikos bei Menschen mit T2DM und CKD in Betracht gezogen werden. Grössere absolute Risikoreduktion mit zunehmender Schwere der CKD. Dies zusätzlich zur modernen «Hintergrundtherapie» mit RAS-H. und Statinen.
Kommentar zur kardio-renalen Protektion
Ein hohes Risiko für eine CKD besteht bei einer Hypertonie, einem T2DM und einer cv-Erkrankung.
Bei Vorliegen eines T2DM und einer atherosklerotischen cv-Erkrankung (ASCVD) oder hohem cv-Risiko besteht, unabhängig vom HbA1c oder der antidiabetischen Begleitmedikation, eine Empfehlung zum frühen Einsatz von SGLT2-Hemmer und/oder GLP-1 RA. Nach den aktuellen Leitlinien (4-6) führen folgende Massnahmen bei einem T2DM und einer CKD zu einer Progressionsverlangsamung der Niereninsuffizienz und zu einer kardiovaskulären Protektion: Konsequente Lifestylemassnahmen mit Vermeidung cv‑Risikofaktoren und als First-Line Medikamente: ACE-Hemmer/ARB in max. verträglicher Dosis – bei Hypertonie und/oder Albuminurie. Zur Blutzuckersenkung: Metformin (eGFR≥ 30), SGLT2-H. (eGFR ≥20) mit kardio-renaler Protektion, Statine: LDL-Ziel: ≤1,4mmol/l mit üblichem Ausbau der modernen Lipidtherapie (Ezetimib/PCSK9-H.). Bei einer ASCVD Gabe eines Plättchenhemmers. Je nach BD (BD-Ziel systol. 120-129 mmHg) evtl. CCB (Dihydropyridine)/Diuretka.
Noch als Second-Line-Medikamente gewertet, zur weiteren Verhinderung von Komplikationen und Komorbiditäten: GLP-1 RA, Finerenon, der neue ns-MRA.
Finerenon reduziert ebenfalls cv- und renale Ereignisse; wird zusätzlich zu ACE-H./ARB bei Patienten mit T2DM und einer eGFR von >60ml/min/1,73m2 mit einer UACR von ≥300mg/g oder einer eGFR von 25–60 und UACR ≥30 empfohlen, um das Risiko für cv-Ereignisse und die Progression des Nierenversagens zu reduzieren (4-6).
Je nach Klinik und Patient mind. 1x jährliches CKD-Screening (eGFR EPI, mehrere UACR-Messungen im Spontanurin) bei T2DM, unabhängig von der Therapie. Neubeurteilung, auch der cv-Risikofaktoren, alle 3-6 Monate. Behandlung von Begleitkrankheiten.
«4-Säulen»-Therapie
Zusammen haben GLP-1 Agonisten und SGLT2-Inhibitoren neben einer stärkeren Bz-Senkung einen grösseren kardio-renalen Nutzen bei Patienten mit einem T2DM (7). Angesichts des signifikanten Nutzens von Semaglutid und SGLT2-H. und des akzeptablen Sicherheitsprofils ihrer Kombination kann diese Option für die Behandlung von Patienten mit T2D und CKD in Betracht gezogen werden (4,8).
Neue Daten deuten darauf hin, dass die kombinierte Anwendung eines SGLT2-H. und Finerenon einen zusätzlichen Schutz vor kardiovaskulären Ereignissen bieten und bei Patienten mit HI, mit und ohne CKD, mit leicht reduzierter oder erhaltener LV-EF (≥ 40%) eine additive Rolle spielen (9,10). In einer Analyse von fast 90 000 Patienten mit T2DM und einer UACR ≥30mg/g wurde gezeigt, dass die «4-Säulen»-Therapie, bestehend aus RAS-H., SGLT2-H., ns-MRA, GLP-1 RA die CKD-Progression um 58% und die Gesamtmortalität um 33% senken konnte – kardio-renaler Schutz (HI, Arteriosklerose, Niere) (11,12).
Darüber hinaus wurde in einer kürzlich durchgeführten gepoolten Analyse aus den Studien SELCT, FLOW, STEP-HFpEF und STEP-HFpEF DM gezeigt, dass Semaglutid das Risiko eines kardiovaskulären Todes und einer Verschlechterung der Herzinsuffizienz bei Personen mit HFpEF in der Vorgeschichte signifikant reduziert (13).
Eine Kombinationstherapie («4 Säulen») ist somit bei Patienten mit Typ-2-Diabetes und CKD bei hohem kardio-renalem Risiko sehr effektiv: mit relevanten Vorteilen im Hinblick auf das kardio-vaskuläre und renale ereignisfreie Überleben sowie das Gesamtüberleben.
Copyright
Aerzteverlag medinfo AG
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch
1. Perkovic V et al., Effects of Semaglutide on Chronic Kidney Disease in Patients with Type 2 Diabetes. Published May 24, 2024. In: NEJM. DOI: 10.1056/NEJMoa240334
2. Pratley R.E. et al., Effects of Semaglutide on Heart Failure Outcomes in Diabetes and Chronic Kidney Disease in the FLOW Trial, J Am Coll Cardiol 2024 Oct 22;84(17):1615-1628
3. Mahaffey K.W. et al., Cardiovascular outcomes with semaglutide by severity of chronic kidney disease in type 2 diabetes: the FLOW trial, Eur Heart J, Volume 46, Issue 12, 21 March 2025, Pages 1096–1108, https://doi.org/10.1093/eurheartj/ehae613
4. Marx N. et al., 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes, European Heart Journal (2023) 00, 1–98, https://doi.org/10.1093/eurheartj/ehad192
5. www.kdigo.org: KDIGO-2024-CKD-GUIDELINE.pdf
6. Marx-Schütt K. et al., Konsensuspapier zum Management kardiovasulärer Erkrankungen bei chronischer Nierenkrankheit, Konsensuspapier DGK u. DGfN, Die Kardiologie 2025, https://doi.org/10.1007/s12181-024-00716-6
7. Williams N.S. et al., GLP-1 Agonists and SGLT-2 Inhibitors Together Have Greater Cardiorenal Benefits, BMJ 2024;385: e078242 http://dx.doi.org/10.1136/ bmj-2023-078242
8. Mann, J.F.E. et al. Effects of semaglutide with and without concomitant SGLT2 inhibitor use in participants with type 2 diabetes and chronic kidney disease in the FLOW trial. Nat Med 30, 2849–2856 (2024). https://doi.org/10.1038/s41591-024-03133-0
9. Salomo S.D. et al., Finerenone in Heart Failure with Mildly Reduced or Preserved Ejection Fraction, FINEARTS-HF, N Engl J Med 2024 September 1, 2024, 391:1475-1485, DOI: 10.1056/NEJMoa2407107
10. Vaduganathan M. et al., Effects of the Nonsteroidal MRA Finerenone With and Without Concomitant SGLT2 Inhibitor Use in Heart Failure, Circulation 2025;151:149–158. DOI: 10.1161/CIRCULATIONAHA.124.072055
11. Neuen BL.et al., Estimated Lifetime Cardiovascular, Kidney, and Mortality Benefits of Combination Treatment With SGLT2 Inhibitors, GLP-1 Receptor Agonists, and Nonsteroidal MRA Compared With Conventional Care in Patients With Type 2 Diabetes and Albuminuria, Circulation 2024;149:450-462, DOI: 10.1161/CIRCULATIONAHA.123.067584
12. Subodh V. et al., Pump, pipes, filter, sugar, weight and more: the pluripotent prowess of semaglutide, European Heart Journal (2025) 46, 1109–1111 https://doi.org/10.1093/eurheartj/ehae744
13. Kosiborod MN. et al., Semaglutid versus Placebo bei Patienten mit Herzinsuffizienz und leicht reduzierter oder erhaltener Ejektionsfraktion: eine gepoolte Analyse der randomisierten Studien SELECT, FLOW, STEP-HFpEF und STEP-HFpEF DM, Lancet 2024; 404:949-961, 10.1016/S0140-6736(24)01643-X